
本次中华医学会检验医学分会分子诊断学组出版CTC检测相关共识,规范行业CTC检测的各项临床及技术标准,将极大地推动行业CTC检测技术的发展。

CTCBIOPSY系统经过10年技术积累,并且不断进行技术创新,充分满足临床及实验室对于CTC检测的需求,达到临床应用及实验室检测的专家共识10条内容的要求标准。
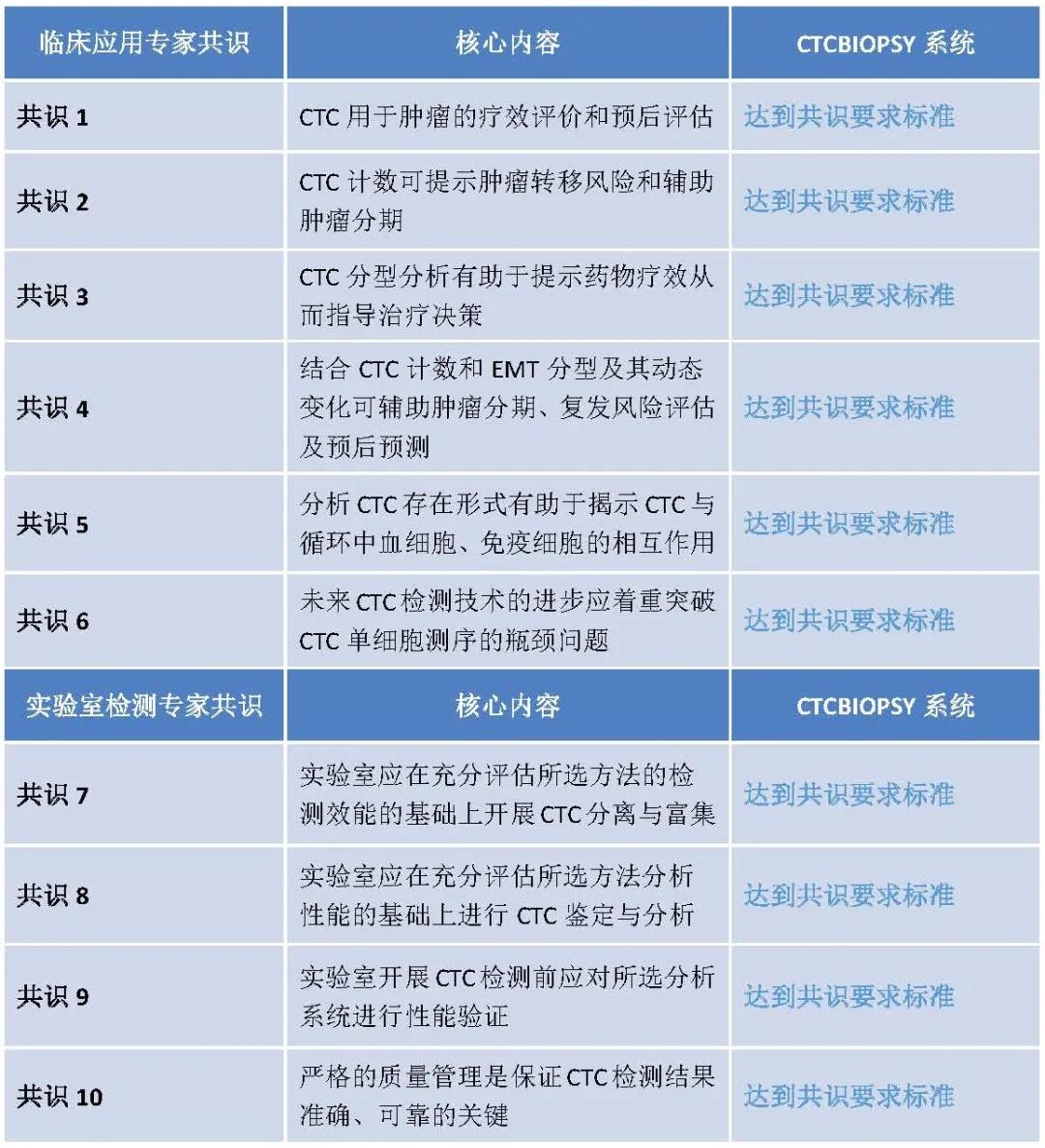
下面针对CTC临床应用及实验室检测专家共识进行解读。
临床专家共识:
共识1:CTC计数可用于乳腺癌、前列腺癌、结直肠癌、肝癌等实体肿瘤的疗效评价和预后评估,应结合具体肿瘤类型和CTC检测方法选择合适的判断阈值;追踪手术前后或综合治疗过程中CTC的动态变化可为肿瘤疗效评价和预后评估提供实时监测信息。
解读:2019年芝友医疗联合临床专家基于CTCBIOPSY检测系统分别在结直肠癌、肝细胞癌和食管鳞状细胞癌应用领域发表了三篇专家共识,共识推荐CTCBIOPSY系统作为CTC检测的优良平台,旨在为临床肿瘤治疗提供指导。

共识2:CTC计数可提示肿瘤转移风险和辅助肿瘤分期,联合CTC计数和影像学、病理学、血清学特征参数有助于更准确地评估肿瘤状态和疾病进展;不建议单独以CTC 计数作为肿瘤早期筛查和诊断的工具。
解读:CTCBIOPSY系统利用专利纳米微筛技术对CTC进行捕获,相较于免疫学捕获方法效率更高,适用于绝大部分实体肿瘤。系统采用经典的病理学判读方法对CTC进行鉴定,检测CTC计数≥5个/5mL提示更差的预后和更高的复发转移风险,对CTC进行动态监测具有显著的临床指导意义,与常规影像学和血清标志物检测相比可更早地响应治疗效果,避免无效治疗。
共识3:CTC分子分型可为全面评估肿瘤状态和肿瘤精准诊疗提供重要的实时信息;基于治疗靶标的CTC分型分析有助于提示药物疗效从而指导治疗决策,如ARV7(前列腺癌内分泌治疗)、HER-2/EGFR/KRAS(靶向用药)、PD-L1(免疫治疗)等。
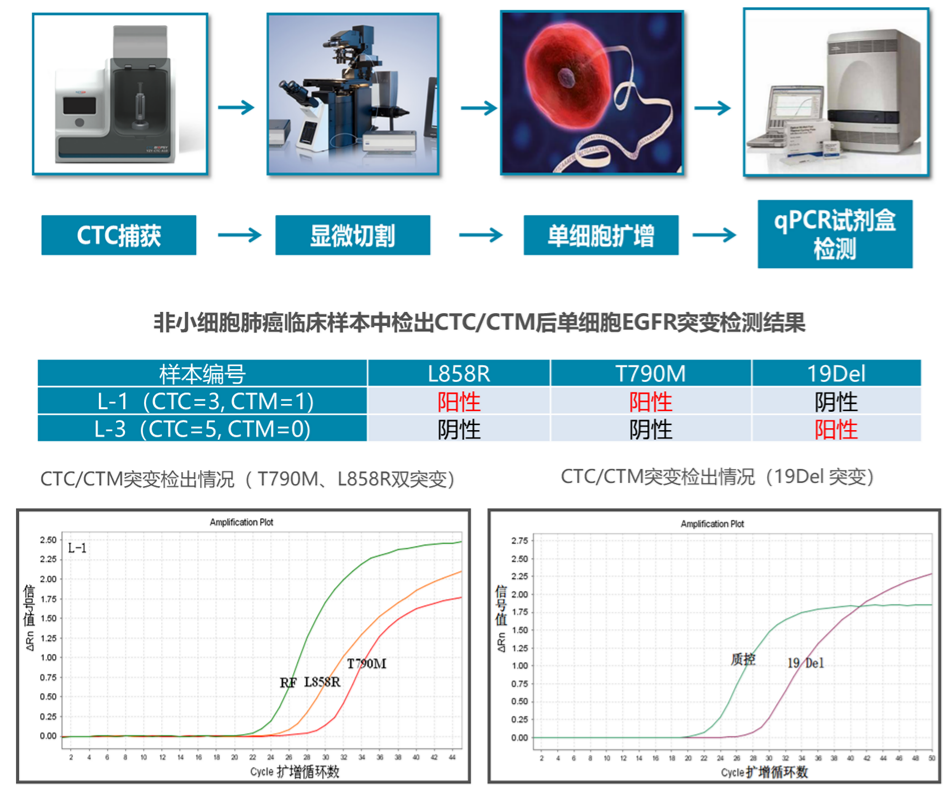
解读:CTCBIOPSY系统富集分离CTC/CTM,对截获的循环肿瘤细胞进行显微切割,然后进行WGA(全基因组扩增)的单细胞基因扩增,最后进行肿瘤靶标分子EGFR、ALK、ROS1、KRAS、NRAS、BRAF、PIK3CA基因检测,辅助预判相应靶向药的疗效,从而提供靶向药物的用药指导。
共识 4:CTC-EMT分型的临床应用价值在多种肿瘤类型研究中得到证实,结合CTC计数和EMT分型及其动态变化可辅助肿瘤分期、复发风险评估及预后预测;针对肿瘤细胞干性和代谢特征的CTC功能分型有助于反映CTC的生物学转归和疾病的发展,是未来泛癌种CTC分子分型发展的前沿方向。
解读:CTCBIOPSY系统采用纳米微筛进行自动化分离,然后使用细胞角蛋白(CK)、波形蛋白(Vimentin)等标记物进行免疫荧光(Immunofluorescence,IF)鉴定。由于肿瘤细胞的高表达CK、Vimentin等标记物,这些标志物可作为肿瘤细胞的鉴定优良指标。CK、Vimentin联合血细胞标志物CD45进行免疫荧光检测,对CTC进行分子水平的检测,对肿瘤的复发转移过程进行实时监测,具有重要的临床意义。

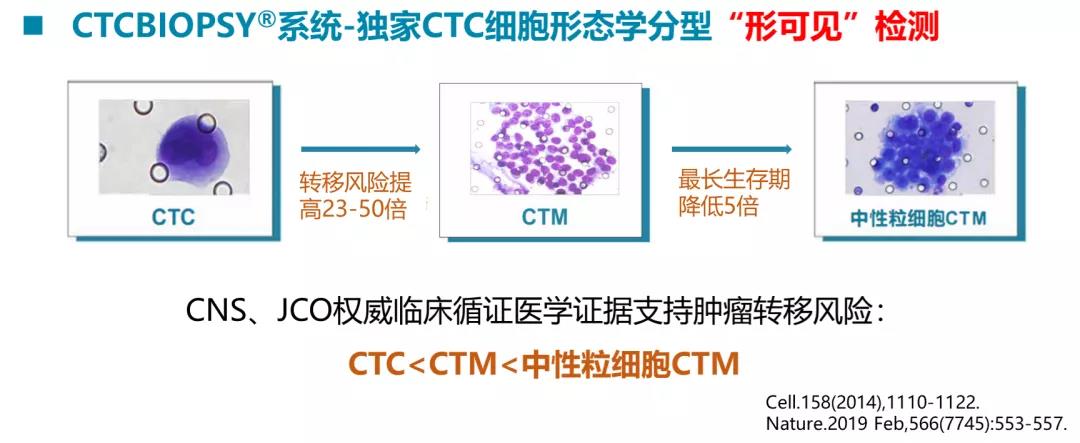
共识5:CTC有多种存在形式,包括单个细胞、CTC 簇或CTC与其他血液成分(白细胞、血小板、巨噬细胞等)聚集成团,CTC细胞团检出率的提高有赖于检测方法的进一步优化;分析CTC的存在形式有助于揭示CTC与循环中血细胞、免疫细胞的相互作用,阐明CTC免疫逃逸和转移播散的机制,是CTC检测领域重要的探索方向。
解读:CTCBIOPSY系统是国内唯一能对CTC、CTM和中性粒细胞CTM精准分型的检测方法,肿瘤患者总体的检出率:CTC :82%,CTM:12%,中性粒细胞CTM:3%;研究表明CTM的侵袭性是单个CTC的23-50倍,而中性粒细胞CTM相比单纯CTM的患者具有更差的预后。
共识 6:CTC体外培养、单细胞测序等下游分析是CTC检测领域的前沿方向,也是精准医学时代CTC临床应用的重要趋势;未来CTC检测技术的进步应着重突破CTC单细胞测序的瓶颈问题,探索单细胞CTC高保真核酸扩增及文库构建等创新技术,以促进CTC单细胞分析的发展和应用。
解读:CTCBIOPSY系统已成功攻克CTC下游单细胞测序技术。CTCBIOPSY系统富集分离CTC/CTM,对截获的循环肿瘤细胞进行显微切割,然后进行WGA(全基因组扩增)的单细胞基因扩增,最后进行肿瘤驱动基因检测,可实现CTC基因组的CNV(拷贝数变异)和WES(全外显子测序)研究分析,满足临床研究及患者个体化诊疗需求。
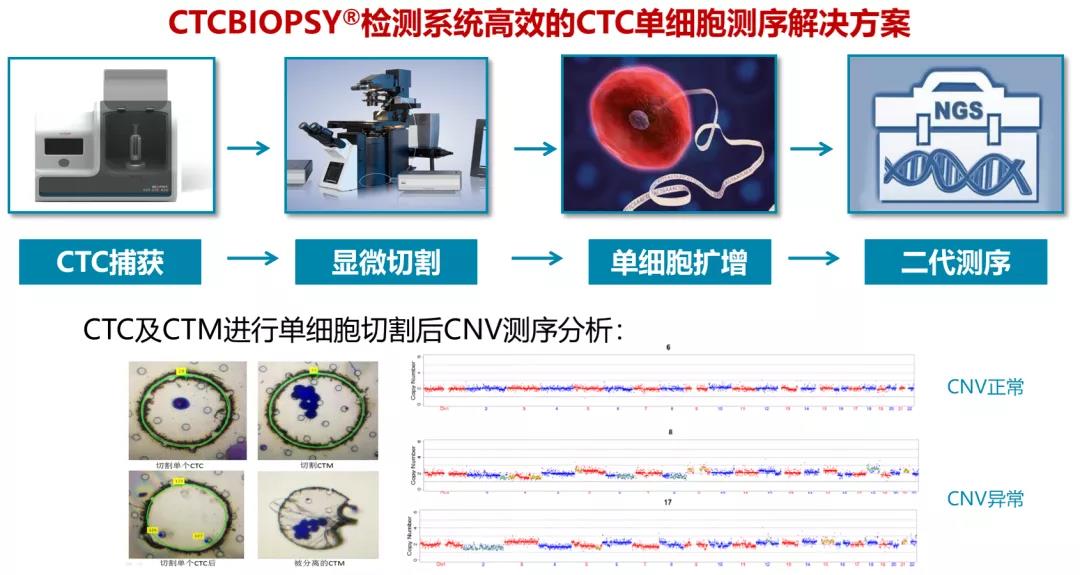
实验室检测专家共识:
共识 7:不同CTC分离与富集技术各有优缺点,实验室应结合应用目的和后续鉴定与分析的要求选择合适的方法;实验室应在充分评估所选方法的检测效能的基础上开展CTC分离与富集。
共识8:CTC鉴定与分析技术的选择应综合考虑上游分离富集技术的特点和下游应用的目的,根据肿瘤类型选择合适的标志物可提高CTC检测的准确性,结合细胞功能特征分析可丰富 CTC 检测的层次以适应临床诊疗的多种需求;实验室应在充分评估所选方法分析性能的基础上进行CTC鉴定与分析。
解读:CTCBIOPSY系统采用物理学原理,基于细胞大小差异对CTC进行富集分离,不依赖于CTC表面标记物,捕获效率高并且可避免漏检。分离过程中采用高精度压力传感控制,实现在体外真实模拟血液细胞在体内的流动状态,最大限度保证CTC完整性和生物活性,便于进行下游各种分析鉴定。


共识9:实验室开展CTC检测前应对所选分析系统进行性能验证,属于实验室自建方法的分析系统还应根据相关要求进行其他参数的性能确认;应注意所选CTC分析系统的适用范围,跨癌种应用时应考虑到不同起源、不同病理类型肿瘤细胞的理化性质不尽相同,须进行充分的性能验证和临床观察研究。
共识10:严格的质量管理是保证CTC检测结果准确、可靠的关键。实验室应针对 CTC检测的各个关键环节,建立完善的质量管理体系以规范分析前、分析中及分析后的操作流程,并做好检测结果解读与临床沟通工作,以保障CTC临床应用的有效性及实用性。
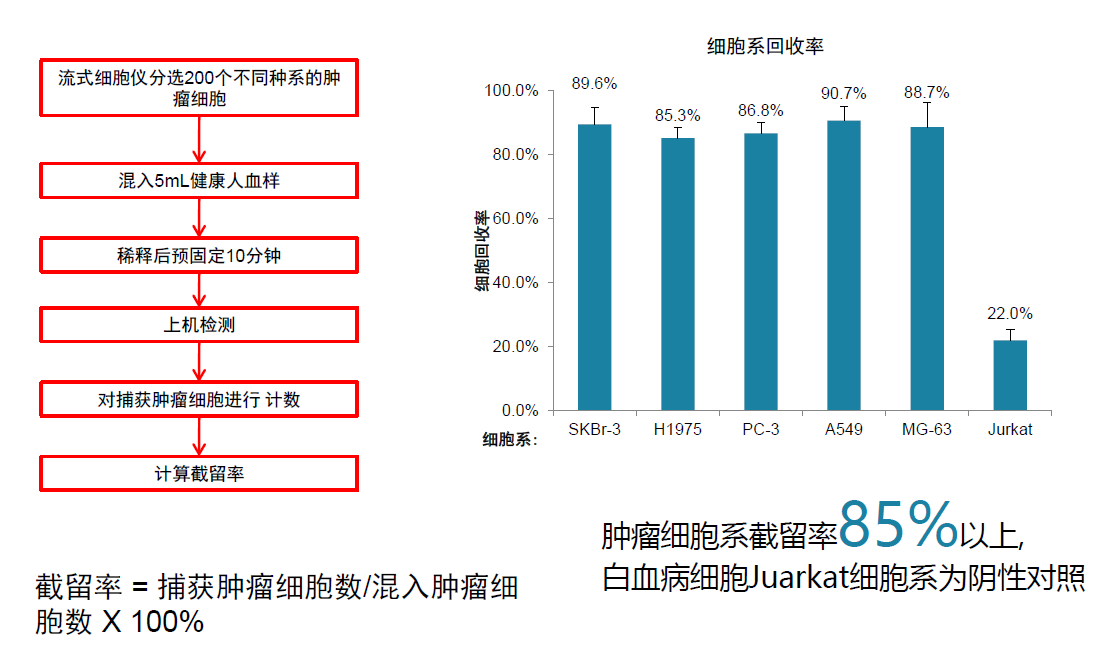
解读:共识中推荐了基于细胞大小差异的CTC分析系统其性能验证常用细胞系为MCF-7、Hela、A549、HepG2、SK-BR-3。CTCBIOPSY系统性能验证使用的细胞系包括SK-BR-3、A549、H1975等细胞系,截留率在85%以上,充分满足实验室的性能验证要求。
最后,期待《循环肿瘤细胞临床应用与实验室检测专家共识》在全国检测终端充分应用,芝友医疗携手行业同仁共同推动循环肿瘤细胞检测行业规范快速发展。




